在298k、101×105Pa下,将22g CO2通入1mol·L-1 NaOH溶液750mL中充分反应,测得反应放出xkJ的热量。已知在该条件下,1mol CO2通入2mol·L-1 NaOH溶液1 L中充分反应放出ykJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
| A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 |
| B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 |
| C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 |
| D.2CO2(g)+2NaOH(l)===2NaHCO3(l) ΔH=-(8x-2y)kJ·mol-1 |
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是()
A.c(K+)+c(H+)=c(HC2O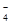 )+c(OH-)+c(C2O )+c(OH-)+c(C2O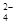 ) ) |
B.c(HC2O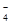 )+c(C2O )+c(C2O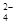 )=0.1mol·L-1 )=0.1mol·L-1 |
C.c(C2O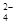 )<c(H2C2O4) )<c(H2C2O4) |
D.c(K+)=c(H2C2O4)+c(HC2O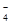 )+c(C2O )+c(C2O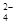 ) ) |
下列说法中正确的是( )
| A.水是极弱的电解质,它能微弱电离生成H+,所以严格地说纯水呈微酸性 |
| B.纯水中c(OH-)×c(H+)=Kw,Kw是一常数,不随任何条件改变而改变 |
| C.25℃时纯水中c(OH-)×c(H+)=10-14,稀酸和稀碱中Kw=c(OH-)×c(H+)≠10-14 |
D.H2O  H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大 H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,KW随之增大 |
在酸性溶液中能大量共存,并且溶液为无色透明的离子组是()
A.NH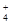 、Al3+、SO 、Al3+、SO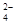 、NO 、NO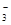 |
B.K+、Na+、CO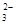 、NO 、NO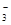 |
C.K+、NH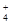 、MnO 、MnO 、SO 、SO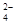 |
D.Na+、K+、NO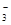 、HSO 、HSO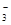 |
下列实验设计及其对应的离子方程式均正确的是( )
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O |
反应4NH3(g)+5O2(g)==4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A.v(NH3)=0.010mol•(L•s)-1 |
| B.v(O2)=0.0010mol•(L•s)-1 |
| C.v(NO)=0.0010mol•(L•s)-1 |
| D.v(H2O)=0.045mol•(L•s)-1 |