100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入数滴氯化铜溶液 | B.加入适量的6 mol·L-1的盐酸 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
25℃时,水中存在电离平衡:H2O  H++OH- △H>0。下列叙述正确的是
H++OH- △H>0。下列叙述正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是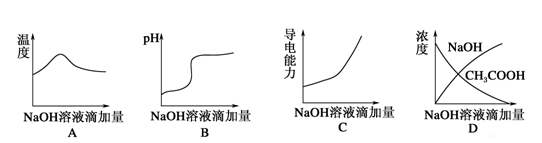
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是
| A.(6a+5d-4c-12b)kJ·mol-1 | B.(4c+12b-6a-5d)kJ·mol-1 |
| C.(4c+12b-4a-5d)kJ·mol-1 | D.(4a+5d-4c-12b)kJ·mol-1 |
在恒温时,一容积可变的密闭容器中发生反应:2NO2(g) N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数
N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |
在一定温度时,4 mol A在2 L的密闭容器里分解,达到平衡时,测得已有50%的A分解成B和C,A(g) 2B(g)+C(g)。此温度时,该反应的平衡常数为
2B(g)+C(g)。此温度时,该反应的平衡常数为
| A.4 | B.3 | C.2 | D.1 |