有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大,将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀。经检验,三种正盐中还含有下列选项中的一种离子,该离子是
A、Na+ B、Mg2+ C、Cu2+ D、Ag+
下列化学用语使用正确的是()
A.质量数为37的氯原子: |
B.Ca2+的结构示意图为: |
C.氢氧化钠的电子式: |
| D.乙烯的结构简式:CH2CH |
下列物质中,可形成酸雨的是()
| A.二氧化碳 | B.氟氯代烃 | C.臭氧 | D.二氧化 硫 硫 |
将15.6 g Na2O2和5.4 g A1同时放入一定量的水中,充分反应后得到200 mL溶液,再向溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的袜积保持不变,则下列说法正确的是()
| A.最终得到7.8g沉淀 |
| B.最终得到的溶液中只含NaCl溶质 |
C.最终得 到的溶液中c(Na+)=1.5mO1/L 到的溶液中c(Na+)=1.5mO1/L |
| D.标准状况下,反应过程中得到6.72L的气体 |
25℃时,在25 mL 0.1 mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与醋酸体积关系如右图,下列分析正确的是()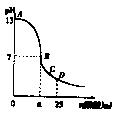
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
下列离子方程式书写正确的是()
| A.盐酸滴人氨水中:H++OH-一H2O |
B.过量的SO2通人NaOH溶液中:SO2+20H-=SO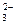 十H2O 十H2O |
| C.Fe(NO2)2溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++2H2O |
| D.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |