某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加 溶液(填化学式),其目的是 。
第二,继续加入过量的该溶液,其目的是 。
第三,再向溶液中加入 溶液(填化学式),确定 离子的存在,其离子反应方程式为 。
从铝土矿(主要成分是 ,含
,含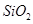 、
、 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为_________________________________________.
(2)固体A的应用_________________________________________.(两点)
(3)滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是__________________________
(5)已知298K时, 的溶度积常数
的溶度积常数 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下容器中金属离子与金属单质的存在情况:
(1)若Fe粉有剩余,则容器中不可能有____________
(2)若FeCl3有剩余,则容器中不可能有___________
(3)若CuCl2有剩余,则容器中还可能有________________________
(4)若FeCl3和CuCl2都有剩余,则容器中还可能有______________
按要求完成以下方程式:
(1)磁性氧化铁溶于盐酸的化学方程式:_________________________________________。
(2)氯化铁溶液中通入SO2气体的离子方程式:_______________ ____________________。
(3)偏铝酸钠溶液中通入过量CO2的离子方程式:_________________________________。
(4)碳单质和浓硝酸反应的化学方程式:_________________________________________。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示):
。
(3)E和氨水反应的离子方程式是________________________________________。
(4)设计实验检验B中所含的阳离子:
。
甲、乙、丙、丁四种物质之间具有如右转化关系: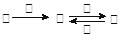
请回答下列问题:
(1)若乙为两性不溶物,则丙转化为乙的离子方程式为;
(2)若丙为形成酸雨的主要物质,则甲的化学式,乙能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式为:
;
(3)若丙中含有目前人类使用最广泛的金属元素,且乙转化成丙为化合反应,则将丙溶液蒸发、灼烧得到的物质是,除去丙溶液中少量乙的方法是:(用化学方程式表示),如何检验乙溶液中的丙,请设计实验方案。