某银白色固体A露置在空气中会被氧化成白色固体B;点燃A,火焰呈黄色,生成浅黄色固体C;A、B、C均可跟无色液体D反应,生成碱性物质E;其中A和D反应时还会生成可燃性气体F,C跟D反应时则可生成另一种气体G;F和G混合后遇火可剧烈反应而发生爆炸并生成D。
(1)写出下列物质的化学式:C ,D ,E 。
(2)写出A与D反应的离子方程式: 。
(3)写出C与D反应的化学方程式: 。
(4)写出B与D反应的化学方程式: 。
已知某氯代烃A的相对分子质量为113,且氯的质量分数是62.8%,A进行核磁共振氢谱分析,谱图中只有两组峰。
(1)A的分子式是_________________________
(2)A有如下的转化关系: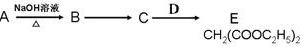
①C中的官能团名称是______________;C可以发生的反应有________________。
a.与氢气加成 b.缩聚反应 c.中和反应 d.水解反应 e.取代反应②D的结构简式为:________________。
(3)巴比妥是一类重要的有机物,其中一些常常可用作镇静和催眠的药物,其结构简式如右图所示 ,R、R’为烃基或氢原子。下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:
,R、R’为烃基或氢原子。下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:
已知:

①写出E转化为F的化学方程式:___________________________。
②巴比妥H的结构简式是_____________________________。
③I有多种同分异构体,其中满足:i属于甲酸酯;ii能使溴的四氯化碳溶液褪色;iii结构中只有一个甲基的共有________种,写出其中任意一种:_________________。
(4)尿素(H2N-CO-NH2)也可与甲醛合成脲甲醛树脂,其可用于耐水性和介电性能要求不高的制品,如插线板、日用品、装饰品,也可用于部分餐具的制造。反应过程如下:
第一步生成聚合前体:
酸性条件:H2N-CO-NH2+ 2HCHO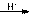 HOCH2NH-CO-NHCH2OH
HOCH2NH-CO-NHCH2OH
碱性条件:H2N-CO-NH2+ 4HCHO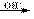 (HOCH2)2N-CO-N(CH2OH)2
(HOCH2)2N-CO-N(CH2OH)2
第二步聚合:
第一步反应得到的聚合前体继续在酸性或碱性条件下发生缩聚反应。
①第一步生成聚合前体的反应属于_________反应;要得到体型的脲甲醛树脂,尿素与甲醛需要在_________(填“酸性”或“碱性”)条件下反应。
②写出由酸性条件下得到的聚合前体通过醚键缩聚得到脲甲醛树脂的化学方程式:
____________________________________________________________________________。
(11分)肉桂酸甲酯是一种常用的调制具有水果香味的食用香精。下图是由A合成聚肉桂酸甲酯等有机物的合成信息:
已知:

②F为由两分子D间反应形成含有三个六元环的酯;

请回答下列问题:
(1)D→G的反应类型是________________;G→H的反应类型是________________;
(2)D转化为E的化学方程式是______________________________________________;
(3)下列物质的结构简式:A_______________________________;F________________;
(4)符合以下条件的D的同分异构体有_____种,写出其中一种的结构简式________________。
①苯环上有2种氢,3个取代基; ②能发生银镜反应; ③遇FeCl3溶液显色。
(5)请用合成路线流程图表示 →G的合成线路,并注明反应条件。
→G的合成线路,并注明反应条件。
提示:①氧化羟基的条件足以氧化有机分子中的碳碳双键;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X |
Y |
Z |
M |
R |
Q |
|
| 原子半径/nm |
0.186 |
0.074 |
0.099 |
0.143 |
||
| 主要化合价 |
-4,+4 |
-2 |
-1,+7 |
+3 |
||
| 其它 |
阳离子核外无电子 |
无机非金属材料的主角 |
焰色反应呈黄色 |
(1)R在元素周期表中的位置是________________;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为________________。
(2)Z的单质与水反应的离子方程式是_________________________。
(3)根据表中数据推测,Y的原子半径的最小范围是________________。
(4)Z、M、Q的简单离子的离子半径的大小顺序为________________。
(5)Y与R相比,非金属性较强的是________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR >YX4
c.Y与R形成的化合物中Y呈正价
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水。若丙的水溶液呈碱性,则丙的化学式是_______________________________。
(7)Y的单质能和Z的最高价氧化物的水化物的水溶液发生反应,生成相同条件下密度最小的气体。请写出该反应的化学方程式_____________________。
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀产生。根据上述实验现象回答下列问题。
(1)其中肯定含有的离子有:________________,无法确定是否含有的离子有:________________。
(2)写出溶液加入适量Na2O2固体,产生无色无味气体的离子反应方程式___________________________。
(3)简述产生白色沉淀在加入足量的NaOH溶液后白色沉淀发生部分溶解现象的原因 ________________________________________________________________________。
(7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3—+4H++3e—→NO+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的离子方程式:________________________________。
(2)反应中硝酸体现的性质有_________、__________。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: _______________________________________________________________________。