实验室配制100mL 0.5mol·L-1的NaOH溶液,有如下操作步骤:
①把称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液待冷却至室温后,用玻璃棒引流小心转入100mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度l—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)配制前,应先用托盘天平准确称取NaOH固体 克;
(2)上述实验操作步骤的正确顺序为(填序号) ;
(3)本实验用到的容量瓶上无需标记的是 ;
| A.温度 | B.刻度线 | C.浓度 | D.容积 |
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度 。
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是;写出工业上制备B的化学反应方程式。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是,C所含共价键的类型和数目比为;反应③的化学方程式是。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都生成有颜色气体,B的结构式是,反应③的化学方程式是。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W元素在周期表中的位置为;写出Y元素原子的价电子排布式:;
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的分子属于(填“极性”、“非极性”)分子。
(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g C气体(已知n(X):n(Y)=3:1)可放出18.44 kJ热量,则该反应的热化学方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物D
①已知1mol D能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下D与NaOH溶液反应的离子方程式。
②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式
。
(5)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为。
[化学——选修有机化学基础]
已知:
ⅰ. 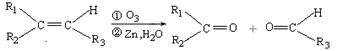 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.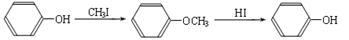
某种芳香族化合物A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。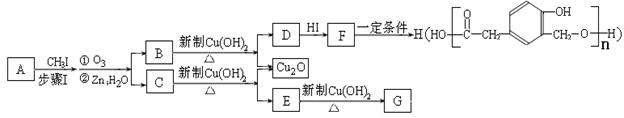
请回答:
(1)① F→H的反应类型是;气体G的相对分子质量是44,则E的结构简式是;
②步骤Ⅰ的目的是;
③A的结构简式是;上述转化中B→D的化学方程式是。
(2)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN只能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上仅有三个取代基且取代基上无支链。请问符合上述要求N的同分异构体有种。
[化学—选修物质结构与性质]
第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式______________________________。
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,右图正方体是Pt晶胞示意图,
叙述Pt原子在晶胞中位置:_______________________。
(3)已知X eO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为;XeO3分子实际空间构型为。
eO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为;XeO3分子实际空间构型为。
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是。
(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数 据判断ΔH10 (填“>”、“=”或“<”)。
据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。