(10分)按要求完成以下内容:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示):_________________________;实验室在配制Fe2(SO4)3溶液时,需要加入________来抑制水解。
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液。
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为______(用“>”“<”或“=”表示,下同)。
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是_____________________;
(3)某温度下,水的离子积常数KW=10-14。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为____________。
已知四种电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-.将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成; ②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收. 试回答下列问题:
(1)写出这四种物质的化学式:A________,B________,C________ ,D ________
(2)写出实验②中有关反应得化学方程式____________________ ____________________.
(1).将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________。
(2).同温同压下,质量相同的五种气体: ① CO2② H2③ O2④ CH4⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
密度由大到小的顺序是_________________________________。
(3).VmL Al2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是(单位为mol/L)______________。
(4).有一质量为mg,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为________,溶质的质量分数为________。
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3v1(填“>”“=”或“<”=,且C31.0 mol·L-1(填“>”“=”或“<”=。
写出下列方程式
(1)惰性电极电解硫酸铜溶液:阳极:阴极:
总反应:
(2)酸性条件下的甲烷燃料电池:负极:正极:
(3)铁做阳极,碳做阴极电解饱和食盐水:阳极:阴极:总反应:
(4)池是一种高能电池,它质量轻、体积小,是人造卫星、宇宙火箭、空间电视转播站等的电源。电极材料为Zn 和Ag2O,电解质是KOH.
总反应式:Zn + Ag2O = ZnO + 2Ag
负极:________________________________________________
正极:________________________________________________
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为________________________________________。
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。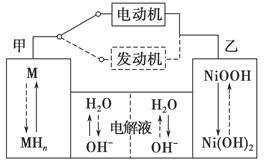
(3)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为2Cu+H2O Cu2O+H2↑,阴极的电极反应式是_______________________________________________________________。
Cu2O+H2↑,阴极的电极反应式是_______________________________________________________________。
用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为________g。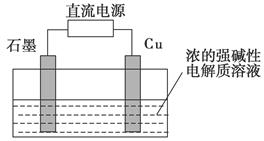
(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________(填“正”或“负”)极相连。