已知①CH3OH(g)+H20(g)=CO2(g)+3H2(g) △H=+49.O kJ/mol
②CH3OH(g)+1/202(g)=CO2(g)+2H2(g) △H=-192.9 kJ/mo1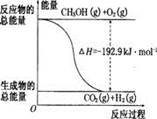
下列说法正确的是
| A.CH30H转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
| C.根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g)△H>一192.9 kJ/mol |
| D.反应②的能量变化如图所示 |
如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于
①2:7②5:4③4:5④7:2
| A.①② | B.②④ |
| C.③④ | D.①③ |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.Cl2+H2O=HCl+HClO |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
NaNO2是一种食品添加剂,既有致癌作用。酸性KMnO4溶液与NaNO2的反应为: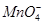 +NO2― +H+=Mn2++NO3―+H2O(未配平)。下列叙述正确的是
+NO2― +H+=Mn2++NO3―+H2O(未配平)。下列叙述正确的是
| A.反应中NO2―是氧化剂 | B.反应过程中溶液pH减小 |
| C.1 mol KMnO4可以消耗2.5 mol NaNO2 | D.该反应可以说明氧化性NO3―>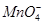 |
下列有关化学事实或现象解释正确的是
| A.加热煮沸MgCO3悬浊液,最终得到Mg(OH)2沉淀,说明Ksp(MgCO3)<Ksp[Mg(OH)2] |
| B.胆矾晶体投入浓硫酸中变成白色固体是化学变化 |
| C.电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 |
| D.气体甲通入溶液乙,溶液乙颜色褪去,说明气体甲一定有漂白性 |
下列叙述正确的是
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀盐酸反应所得溶液均呈中性
C.Li、Na、K的原子半径和密度随原子序数的增加而增加
D.C、P、S、Cl的高价氧化物对应水化物的酸性逐渐增强