下列说法正确的是
| A.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸 |
| B.用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞 |
| C.若用50ml 0.55mol/L的NaOH溶液,分别与50ml 0.50mol/L的盐酸和50ml 0.50mol/L的硫酸充分反应,两反应的中和热相等 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
| A.用量筒量取浓盐酸俯视读数 | B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶瓶颈刻度线 | D.摇匀后见液面下降,再加水至刻度线 |
用已准确称量过的NaOH的固体配制1.00 mol·L-1的NaOH溶液0.5 L,要用到的仪器是( )
①坩埚②分液漏斗③容量瓶④烧瓶⑤胶头滴管⑥烧杯⑦玻璃棒⑧托盘天平⑨药匙
| A.③④⑤⑦ | B.①②⑤⑥⑧ | C.③⑤⑥⑦ | D.③①⑤⑥⑦ |
在100 g浓度为18 mol·L-1、密度为ρ g·mL-1的浓H2SO4中加入一定量的水稀释成9 mol·L-1的H2SO4,则加入的水的体积为( )
| A.小于100 mL | B.等于100 mL | C.大于100 mL | D.等于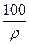 mL mL |
配制100 mL 1 mol·L-1 NaOH溶液,下列操作中错误的是( )
| A.在托盘天平上放两片大小一样的纸,然后将NaOH放在纸片上进行称量 |
| B.把称得的NaOH放入盛有适量蒸馏水的烧杯中,溶解,冷却,再把溶液移入容量瓶中 |
| C.用适量蒸馏水洗涤烧杯、玻璃棒2—3次,洗涤液也移入容量瓶中 |
| D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度线相切 |
将含溶质的质量分数为a%,物质的量浓度为c1 mol·L-1的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时溶液的物质的量浓度为c2 mol·L-1,则c1和c2的关系为( )
| A.c2=2c1 | B.c2<2c1 | C.c2>2c1 | D.c1=2c2 |