对可逆反应4NH3(g) + 5O2(g)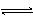 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2) = 5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:2v正(NH3) = 3v正(H2O) |
下列说法正确的是
| A.同一条件下,不同物质的量浓度的氨水的电离程度是相同的 |
| B.强电解质都是离子化合物,弱电解质都是共价化合物 |
| C.反应能否自发进行与温度有关 |
| D.能自发进行的化学反应,一定是△H>0、△S>0 |
亚硝酸(HNO2)的下列性质中,不能证明它是弱电解质的是
| A.常温下,把pH=2的亚硝酸溶液稀释100倍后pH=3.5 |
| B.常温下,0.1mol/L的亚硝酸溶液的PH约为2 |
| C.100mL l mol/L的亚硝酸溶液恰好与100mL l mol/L的NaOH溶液完全反应 |
| D.常温下,等物质的量浓度的亚硝酸溶液和盐酸分别与碳酸钠粉末反应,前者反应产生的气体速率较慢 |
在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g) N2O4(g) △H<0,把烧瓶置于100℃的水中,则下列几项性质中不会改变的是:①颜色 ②平均相对分子质量 ③质量
N2O4(g) △H<0,把烧瓶置于100℃的水中,则下列几项性质中不会改变的是:①颜色 ②平均相对分子质量 ③质量
④压强 ⑤密度
| A.①和③ | B.②和④ | C.③和⑤ | D.④和⑤ |
常温下,在PH=2的硫酸溶液中,水电离出来的H+的物质的量浓度为
| A.10-2 mol/L | B.10-12 mol/L | C.2×10-12 mol/L | D.0.02mol/L |
合成氨的反应是:N2(g)+3H2(g)  2NH3(g) △H<0。使反应进行程度增大的方法是
2NH3(g) △H<0。使反应进行程度增大的方法是
| A.升高温度 | B.降低压强 | C.使用催化剂 | D.及时分离出NH3 |