合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的放热反应:N2(g)+ 3H2(g) 2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
下列物质的除杂方法中,合理的是()
①SO2中混有的SO3杂质可以让混合气体通过浓硫酸除去;②K2CO3中混有的少量NaHCO3,可以用加热的方法除去;③乙烯中混有的SO2气体可以通过溴水除去;④金属铜中含有的少量银和锌可以通过电解精炼的方法除去;⑤KNO3中含有的少量NaCl可以通过重结晶的方法除去。
| A.①②④ | B.①④⑤ | C.①②④⑤ | D.①②③④⑤ |
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2403℃,镓有过冷现象(即冷至熔点以下不凝固),它可过冷到-120℃。下列有关镓的性质及其用途的叙述不正确的是()
| A.镓是制造高温温度计的上佳材料 |
| B.镓能溶于强酸或强碱溶液中 |
| C.镓与锌、锡等金属制成合金,可提高其硬度 |
| D.镓可用于制造半导体材料,这是因为镓的导电性介于导体和绝缘体之间 |
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。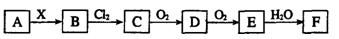
下列说法中不正确的是()
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
用NA表示阿伏加德罗常数的值。则下列说法正确的是()
| A.标准状况下,22.4L己烷中共价键数目为19NA |
| B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
| C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3) |
| D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是()
①ω= ②C=
②C=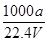
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)> c(NH4+)> c(H+)> c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |