化学反应C(s)+H2O(g)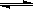 CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是( )
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是( )
| A.加入水蒸气使容器压强增大,平衡向逆反应方向移动 |
| B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.减小压强,平衡向正反应方向移动 |
| D.加入固体碳,平衡向正反应方向移动 |
25℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= ―Q2 KJ/mol, 2H2(g)+O2(g)==2H2O(1) △H3 = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是()
| A.放出的热量为(0.4Q1+0.05Q3)KJ/mol |
| B.放出的热量为(0.4Q1+0.05Q2)KJ/mol |
| C.△H2 > △H3 |
| D.△H2 <△H3 |
下列各组溶液,同时开始反应,出现浑浊最早的是
| A.20℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
| B.20℃时 50mL 0.1mol·L-1 Na2S2O3溶液与50mL 0.1mol·L-1硫酸混合 |
| C.10℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
| D.10℃时 5mL 0.1mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
在2A+B  3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.v(A) = 0.5mol·L-1·S-1 B.v(B) =" 0.3" mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D)=" 1" mol·L-1·S-1
在一定条件下,反应N2+3H2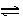 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
| A.V(H2)=0.03mol/(L·min) | B.V(N2)="0.02mol/(L·min)" |
| C.V(NH3)=0.17mol/(L·min) | D.V(NH3)=0.01mol/(L·min) |