有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,大小顺序为______。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n1 mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为___________________________________________。
(4)与等量锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为________。
据香港《壹周刊》报道,国际影星成龙代言的“霸王”品牌旗下的中草药洗发露、首乌黑亮洗发露以及追风中草药洗发水,经过香港公证所化验后,发现均含有被美国列为致癌物质的二恶烷( )。
)。
(1)二恶烷别名二氧六环(1,4-二氧己环),为无色液体, 稍有香味,主要用作溶剂、乳化剂、去垢剂等,其分子式为。
稍有香味,主要用作溶剂、乳化剂、去垢剂等,其分子式为。
(2)二恶烷可以由原料A制备,制备流程如下所示:
请回答下列问题:
①A的结构简式为,C的名称是。
②Ⅰ的反应类型是,Ⅲ的反应类型是。
③Ⅱ的化学方程式为,
Ⅲ的化学方程式为。
(3)二恶烷的同分异构体D既能发生水解反应,又能发生银镜反应,写出D的结构简式。
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中 铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔 是有机合成工业的一种原料。工业上曾用
是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可
的电子式可 表示为;1mol
表示为;1mol  中含有的
中含有的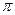 键数目为_。
键数目为_。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为_。
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中② 、④、⑨分别位于晶胞的体心、顶点、面心),则该
、④、⑨分别位于晶胞的体心、顶点、面心),则该 化合物的化学式为(用对应的元素符号表示)。
化合物的化学式为(用对应的元素符号表示)。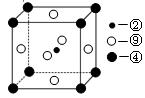
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是。
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y ,将过量的Y气体通入盛有硝酸银水溶液的试管里,发生化学反应所对应的离子方程式为
。
(4)下表为原子序 数依次增大的短周期元素A~F的第一到第五电离能数据。
数依次增大的短周期元素A~F的第一到第五电离能数据。
| 电离能I(eV) |
A |
B |
C |
D |
E |
F |
| I1[来源:学&科&网] |
11.3 |
14.5 |
13.6 |
5.2 |
7.6 |
6.0 |
| I2 |
24.4 |
29.6 |
35.1 |
49.3 |
15.0 |
18.8 |
| I3 |
47.9 |
47.4 |
54.9 |
71.6 |
80.1 |
28.4 |
| I4 |
64.5 |
77.5 |
77.4 |
98.9 |
109.2 |
112.0 |
| I5 |
392.1 |
97.9 |
113.9 |
138.3 |
141.3 |
153.7 |
请回答:表中的金属元素是(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是。
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D 与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式___________________
;同主族的第四周期元素基态原子的外围电子排布图为
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序(用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是 (写出化学式)
(写出化学式)
(4)F分子的中心原子杂化类型是,E易溶于F,其原因是
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的的名称是____________.
(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为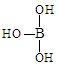 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
(5)已知:下列化学键的键能(KJ/mol),Si—O;460,Si—Si:175,O=O:498,则反应Si+O2= SiO2的反应的△H=_________