(2分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
有A、B、C、D四种短周期元素。已知一个B原子核的原子受到α粒子的轰击得到一个A原子的原子核和一个C原子的原子核,又知C、D元素同主族,且能发生下面两个反应,如下图:
A、B化合物+B、C化合物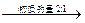 B单质+A、C化合物
B单质+A、C化合物
A、D化合物+D、C化合物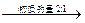 D单质+A、C化合物
D单质+A、C化合物
请完成下列问题。
(1)比较B、C原子半径大小;画出D离子的结构示意图。
(2)分别写出上述两个反应方程式。
(10分)已知金晶体是面心立方晶格(如下图所示)。金的原子半径为114 pm,试求金的
密度。(1 pm=10-10 cm)
(8分)某离子晶体的晶胞结构如图所示。
试求:
(1)晶体中每一个Y同时吸引着________________个X,每个X同时吸引着_____________个Y,该晶体的化学式是________________________________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为Na,则晶体中两个距离最近的X中心间的距离为________________cm。
某元素的同位素 ,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:①称量a g样品,置于烧杯中。②加入适量蒸馏水,使样品溶解。③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。④过滤,用蒸馏水洗涤沉淀。⑤加热干燥沉淀物。⑥将沉淀物冷却至室温后,称量。⑦重复⑤⑥操作直到合格,最后得到b g固体。
完成下列问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?_____________。其理由是_____________。
(2)步骤③中加盐酸使溶液呈现强酸性的目的为_____________________。
(3)步骤⑦“合格”的标准是___________________________________。
(4)实验测得样品中无水亚硫酸钠的质量分数是_______________。(列出算式,不需化简)