(1)已知某反应的平衡常数表达式为:K= ,则它所对应反应的化学方程式是 。
,则它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H="-90.8" kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H="-90.8" kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度(mol/L) |
0.2 |
0.1 |
0.4 |
(A)该时间段内反应速率v(H2)=
(B)比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(C)反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向
(填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。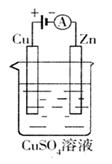
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是;
正极的电极反应式是。
(3)下图是一个电化学过程示意图。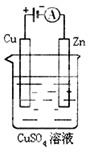
①锌片上发生的电极反应是。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是。
某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是;
(2)c(H2A)最大的是,最小的是;
(3)c(A2-)最大的是,最小的是。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
根据两反应本质,判断能否设计成原电池:A、_________,B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因________________________________________________________;
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
(10分)向淀粉溶液和碘水的蓝色混合溶液中通氯气,溶液褪为无色,该反应体系有反应物和生成物共五种物质:I2、HIO3、H2O、Cl2、HCl。
(碘单质遇淀粉变蓝)
(1)该反应中发生氧化反应的物质是__________,氧化剂是___________,
(2)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目,
(3)如反应转移了0.3 mol电子,则至少需要氯气体积(标准状况下)为_________。
(11分) 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D为单质,E为氯气,试回答: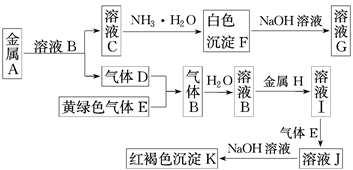
(1)写出下列物质的化学式:A是________,D是________,K是________。
(2)写出反应“C→F”的离子方程式:_____________________________________________。
(3)写出反应“F→G”的化学方程式:_____________________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象及化学方程式:
_________________________________,___________________________________。