盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由下图判断下列关系错误的是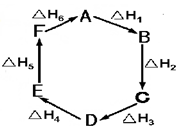
| A.A→F,△H =" -" △H 6 |
| B.△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1 |
| C.C→F,|△H| = |△H 1+△H 2+△H 6 | |
| D.△H 1+△H 2+△H 3 = -△H 4-△H5-△H 6 |
下列说法正确的是
| A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 |
| B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 |
| C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 |
| D.铜、石墨均导电,所以它们是电解质 |
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)=" 6.8×10" - 4 mol·L-1、 Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)=" 6.4×10" - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
| A.HCN溶液 | B.HF溶液 | C.CH3COOH溶液 | D.HNO2溶液 |
反应X(g)+Y(g)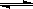 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s) + CO2(g)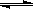 2CO(g),不能判断反应已经达到化学平衡状态的是
2CO(g),不能判断反应已经达到化学平衡状态的是
| A.v(CO2)= v(CO) | B.容器中总压强不变 |
| C.容器中混合气体的密度不变 | D.容器中CO的体积分数不变 |