相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g)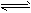 2NH3 (g),△H=" -" 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3 (g),△H=" -" 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系 能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q="23." 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量小于23. 15kJ
由短周期元素组成的常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。若
A.X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.A是单质,B和D的反应是OH-+HCO3-→H2O+CO32-,则E一定能还原Fe2O3
C.X是O2,且C与D摩尔质量相差16,则A一定为Mg3N2
D.D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡 常数(25 ℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-)
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应2S2Cl2+2H2O→4HCl+SO2↑+3S↓。在该反应中
| A.S2Cl2既作氧化剂又作还原剂 |
| B.氧化产物与还原产物物质的量比为3:1 |
| C.每生成22.4L SO2转移3mol电子 |
| D.每生成48g硫会断裂6mol共价键 |
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中
| A.不含SO42- |
| B.含有的阴离子一定是OH-、AlO2-、SiO32- |
| C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32- |
| D.含有AlO2-与SiO32-的物质的量之比为3:1 |
已知: , 如果用丙烯与异戊二烯在该条件下反应,最多可以生成含六元环的化合物(不考虑立体异构)
, 如果用丙烯与异戊二烯在该条件下反应,最多可以生成含六元环的化合物(不考虑立体异构)



| A.6种 | B.4种 | C.3种 | D.2种 |