两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是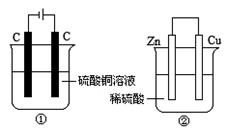
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- →2H2O+O2↑②中负极:2H++2e-→H2↑ |
| D.溶液的pH变化:①减小,②增大 |
质量分数为a的某物质的溶液m g与质量分数为b的该溶液n g混合后,蒸发掉p g水,得到的溶液每毫升的质量为q g,物质的量浓度为C,该溶质的分子量为()
| A.q(am+bn)/c(m+n-p) | B.c(m+n-p)/q(am+bn) |
| C.1000q(am+bn)/c(m+n-p) | D.c(m+n-p)/1000q(am+bn) |
某同学在实验报告中记录下列数据,其中正确的是()
| A.用25ml量筒量取12.50ml盐酸 |
| B.用托盘天平称量8.75g食盐 |
| C.用500ml的容量瓶配置450ml溶液 |
| D.用广泛pH试纸测得某溶液的pH为3.5 |
用NA表示阿伏伽德罗常数,下列叙述正确的是()
| A.64gSO2含有氧原子数为1NA |
| B.物质的量浓度为0.5mol/L的MgCl2溶液,含有Cl-数为1NA |
| C.标准状况下,22.4LH2O的分子数为1NA |
| D.常温常压下,14gN2含有分子数为0.5NA |
若标况下,1体积水溶解700体积的氨气所得溶液密度为0.9g/cm3。这种氨水的物质的量浓度和溶质的质量分数分别为()
| A.18.4mol/L 34.7% | B.20.4mol/L 38.5% |
| C.18.4mol/L 38.5% | D.20.4mol/L 34.7% |
在一定温度下有分解反应A(s)=B(s)+C(g)+4D(g).若测得生成的气体的质量是同温同压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为()
| A.120.4g/mol | B.50.4g/mol | C.182.4g/mol | D.252g/mol |