研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3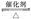 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH="—196.6" kJ/mol ;
2SO3(g) ΔH="—196.6" kJ/mol ;
2NO(g)+O2(g) 2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________ kJ/mol。
SO3(g)+NO(g) ΔH 的ΔH=________ kJ/mol。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1 mol SO3的同时生成1 mol NO2 |
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是____________________________ __。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1) 画出①的原子结构示意图:______________,⑩的元素名称:____________
(2) ③④⑤原子半径由大到小的顺序是______________________(填元素符号)
(3) 表中最活泼的金属是_________,非金属性最强的元素是________;(填写元素符号)
(4) 表中能形成两性氢氧化物的元素是__________,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:
______________________________________________________________________。
(5) 用电子式表示③与⑥的化合物的形成过程:
______________________________________________________________________。
由铜、锌和稀硫酸组成的原电池中: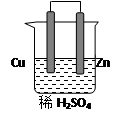
锌是极,电极反应式是。
铜是极,电极反应式是。
在铜极上可以观察到有(填实验现象)
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。请回答下列问题:
2PbSO4+2H2O。请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。
(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。
化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1。则:
①A+B→C+D表示的离子方程式为。
②标准状况下,若2.24L的D被50mL 1mol/L硫酸吸收,则所得溶液中各离子浓度从大到小的顺序为____。
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应。则:
①A+B→C+D表示的化学方程式为。
②D与NaOH溶液反应的化学方程式为___。
③若将B溶于盐酸后,再加入足量NaOH溶液可观察到的现象为。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=,以NH3表示该过程的反应速率v(NH3)= 。
(5)实验室制取氨气的化学反应方程式 .