N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物。
(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物。尿素中元素原子半径最大的原子结构示意图为 ;
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂。
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式
②制备NH2OH·HCl(盐酸羟胺)的一种工艺流程如下图所示: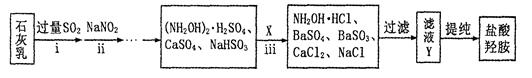
ⅰ步骤中,发生反应的化学方程式为 ;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒。可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害。写出NO2ˉ在酸性条件下转化为氮气的电极反应式为 。
下表为元素周期表的一部分用元素符号或化学式回答下列问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
① |
⑦ |
④ |
||||
| 3 |
③ |
⑤ |
⑧ |
⑩ |
||||
| 4 |
② |
⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________,该分子含有________(填“极性”或“非极性”)键。26号Fe元素在元素周期表中的位置是。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为。第三周期中除⑩元素以外离子半径最小的是(填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是(填化学式),元素⑦的氢化物的结构式为;该氢化物和元素④单质反应的化学方程式为。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为。
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式。
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式;该化合物与二氧化碳的方程式为;④⑧⑨元素的离子的还原性由强到弱顺序为(用离子符号答题)。
4g D2和20g18O2化合时最多能生成g D218O,1mol D218O中含mol质子,含mol中子。
有下列物质:①CaCl2 ②PH3 ③H2O2 ④Na2O2 ⑤KOH ⑥(NH4)2SO4 ⑦F2(答题填编号)
(1)含有离子键的物质,含有非极性键的离子化合物;
(2)含有极性键的物质;
(3)含有非极性键的共价化合物;
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为 C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A可以聚合,写出A发生加聚反应的方程式________________________________。
(2)A与某烷发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式___________________________。
(3)将A通入溴的四氯化碳溶液中发生的反应类型为__________________,
写出该反应的方程式_______________________________。
(4)A的单烯烃同分异构体中,有一种具有顺反异构,分别写出该顺反异构的结构简式
_____________________________、______________________________
(共14分)锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)a电极为__________极(填“正”或“负”)。
(2)电池正极反应式为_______________________。
(3)是否可用水代替电池中的混合有机溶_______(填“是”或“否”),原因是_________________。
(4)MnO2与双氧水混合化学方程式为;MnO2的作用是。
(5)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为________________,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。