钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-= Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-= 4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
下列对实验过程的评价正确的是
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 |
| B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- |
| C.某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
| D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-六种子已知甲烧杯中的溶液呈蓝色,则乙烧杯中大量存在的离子组是
| A.Cu2+、K+、H+ | B.K+、CO32-、OH- |
| C.CO32-、OH-、NO3- | D.K+、H+、NO3- |
取100mL1.05 mol·L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中硫酸的物质的量浓度是
| A.0.21 mol·L-1 | B.0.42 mol·L- | C.0.56 mol·L-1 | D.0.26 mol·L-1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,22.4LCO2含有的分子数为1NA |
| B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
| C.通常状况下,NA个CO2分子占有的体积约为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA |
下列反应中必须加入还原剂才能实现的是
A.Fe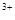 →Fe →Fe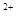 |
B.Zn→ Zn2+ | C.H 2→H2O | D.CuO→CuCl2 |