氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=" -92.4" kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
2NH3(g) ΔH=" -92.4" kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)若恒容下升高温度,则混合气体的相对分子质量 ;密度 。(填“变大”“变小”或“不变”)。
(3)若充入氩气,并保持压强不变,平衡将 ;(填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热, 加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
某温度下,纯水的c(H+)=2.0×10-7 mol/L,则此时c(OH-)为__________________,KW=________,温度不变,向水中滴入稀盐酸,使c(H+)=5.0×10-5 mol/L,则c(OH-)为__________。
对于反应2A(g)+B(g) 2C(g)+Q (Q>0),下列图象正确的是
2C(g)+Q (Q>0),下列图象正确的是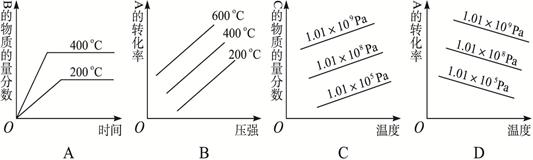
下图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学反应方程式为_____________________________________。
(3)若达到平衡状态的时间是2 min,A物质的平均反应速率为 。
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,则氢气燃烧的热化学方程式是。
有一透明溶液,可能含有较大量的NH4+、Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验:
(1)取少量溶液加入用盐酸酸化的BaCl2溶液有白色沉淀生成:
(2)取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出
无色无味的气体,加入过氧化钠的物质的量与析出沉淀。
的物质的量如图所示,推断:
①溶液中一定含有的离子是___________________________。
②溶液中肯定不含有的离子是________________________________。
③可能含有的离子是________________________________________________。