(10分,每空2分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6试回答下列问答:
(1)步骤①加入的指示剂是 。
(2)步骤②应使用 式滴定管。
(3)判断达到滴定终点的实验现象是 ;
(4)氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
| A.酸式滴定管未用标准盐酸溶液润洗 |
| B.锥形瓶未用待测液润洗 |
| C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了 |
| D.滴定时将标准液溅出锥形瓶外 |
在春夏之交的夜晚,墓地周围常出现“鬼火”,即磷火,这是尸骨中的Ca3P2与水反应生成PH3,PH3自燃的结果,写出Ca3P2与水反应的化学方程式:__________,再写出PH3发生自燃的化学方程式:_______________。
(1)舞台上的幕布与布景多是用浓NH4Cl溶液浸过制成的,可以防火,其原因是_____________________________。
(2)已知NH3结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂是_______,实现转化的离子方程式为______________________________________。
(3)氮的氧化物NOx与NH3反应生成N2和H2O,若在标准状况下1.5 L NOx和2 L NH3恰好完全作用,写出反应的化学方程式:____________________________,NOx中x值为___________。
根据下列变化进行推断:
已知强热A产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A____________、B____________、C____________、D____________。
(2)写出①②变化的离子方程式。
一种无色澄清溶液可能含有K+、SO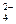 、NH
、NH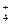 、Ba2+、H2PO
、Ba2+、H2PO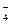 、NO
、NO 中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
下图中①~ 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
(1)①③④的化学式分别是 、 、 。
(2)⑧与⑨反应的化学方程式是 。