为探究铁质材料与热浓硝酸的反应,某学习小组进行了以下实验:
[探究一]
(1)铁钉放在浓硫酸中浸泡后,再用蒸馏水冲洗,然后放入硫酸铜溶液中,铁钉表面无明显变化,其原因是_____________________。
(2)另称取铁钉6.0g放入15.0ml浓硝酸中,加热,充分应后得到溶液M并收集到气体N。为了探究溶液M中铁元素的价态,甲同学设计了如下实验:
有药品:
| A.稀盐酸溶液 |
| B.稀硫酸溶液 |
| C.淀粉KI溶液 |
| D.KMnO4溶液 |
E.NaOH溶液
F.H2O2溶液
G.KSCN溶液
仪器:试管和滴管
步骤1.取试样,滴加少量的______(填试剂字母),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________________。
步骤2.再去适量的试样滴加少量的______(填试剂字母),若溶液_______,则试样中含有Fe2+。
[探究二]
乙同学设计以下装置探究气体N的成分。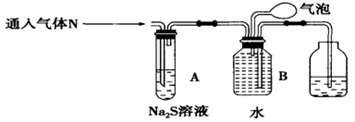
(3)A装置的作用:______________________。
(4)B装置收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体N中含NO____(填“能”或“不能”)?理由是________________。
在298K时,热化学方程式:2H2(g)+O2(g)=2H2O (l)△H=-571.6KJ/mol 表示的意义是______________________________________;H2(g)+1/2O2(g)=H2O (l)△H=_______。
21世纪的新领域纳米技术正日益受到各国科学家的关注,2000年美国总统克林顿宣布了国家纳米倡议,并于2001年财政年度增加科技支出的26亿美元中,其中5亿给纳米技术。
请根据图回答下列问题: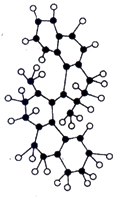
(1)纳米是单位,1纳米等于米。纳米科学与技术是研究结构尺寸在1至100纳米范围内材料的性质与应用。它与分散系的粒子大小一样。
(2)世界上最小的马达,只有千万分之一个蚊子那么大,如图,这种分子马达将来可用于消除体内垃圾。
①该图是马达分子的(填“比例模型”或“球棍模型”)。
②该分子中含有的组成环的原子是元素的原子,分子中共有个该原子。
研究离子晶体,常考查1个离子为中心时其周围不同距离的离子对它的吸引和排斥的静电作用力。设NaCl晶体中Na+与 离它最近的Cl-之间的距离为d,以其中1个Na+为中心,其他离子可看做围绕此Na+分层排布,则:
(1)第二层离子是离子,有个,离中心离子的距离为。
(2)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的根本原因。假设某氯化钠纳米颗粒的大小和形状恰好和NaCl晶胞的相同,求这种纳米颗粒的表面原子占总原子数的百分比。
(3)假设某氯化钠颗粒也是立方体,但其边长为NaCl晶胞边长的10倍,试估算表面原子占总原子数的百分比。
萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为()
| A.2 | B.4 |
| C.6 | D.8 |
BaCl2是无色晶体,熔点963℃,沸点1560℃,溶于水,水溶液能导电。它可能属于________________晶体。