有下列反应:①由乙烯制乙醇 ②甲烷在空气中燃烧
③由乙炔制氯乙烯 ④丙烯使溴水褪色 ⑤苯与浓硝酸、浓硫酸的混合酸反应 ⑥用丙烯制聚丙烯
其中属于取代反应的是(填序号,下同) ,属于氧化反应的是 ,
属于加成反应的是 ,属于加聚反应的是 。
如图:在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白: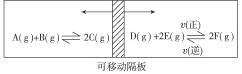
若x=4.5,则右侧反应在起始时向____________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于______________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量_________(填“相等”“不相等”或“不能确定”)。其理由是_______________。
下图所示是可逆反应A+2B 2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况: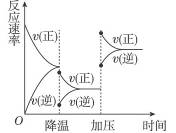
由图可判断:
(1)正反应是_____________(吸热、放热)反应。
(2)若A、B是气体,则C的状态是__________,D的状态是______________。
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
| 压强/kPa |
13.33 |
53.32 |
101.3 |
| K的沸点/℃ |
590 |
710 |
770 |
| Na的沸点/℃ |
700 |
830 |
890 |
| KCl的沸点/℃ |
1 437 |
||
| NaCl的沸点/℃ |
1 465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| AgNO3 |
Ba (NO3)2 |
AgCl |
BaCl2 |
|
| H2O(l) |
170g |
9.20g |
1.50×10-4g |
33.3g |
| NH3(l) |
86.0g |
97.2g |
0.80g |
0.00g |
①上述四种物质能在水中发生的复分解反应为___________________________;
②能在液氨中发生的复分解反应为_____________________________________。
(1)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至钡离子恰好沉淀完全,请写出发生反应的离子方程式:。
(2)在以上溶液中,继续滴加NaHSO4溶液,请写出此步反应的离子方程式:。