在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
| A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小 |
| B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱 |
| C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼 |
| D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成 |
SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化,下列说法不正确的是
| A.上述过程中,最终被还原的是NO3— |
| B.从上述反应可以得出结论,氧化性:HNO3>Fe3+>稀硫酸 |
| C.上述过程中,会产生一种无色难溶于水的气体 |
| D.假设通入的 SO2完全反应,则同温同压下,SO2和逸出气体的体积比为 1∶1 |
饱和氯水中存在如下平衡:①Cl2+H2O H++Cl-+HClO ;②HClO
H++Cl-+HClO ;②HClO H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是()
H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是()
| A.加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 |
| B.加入澄清石灰水,c(H+)一定减小 |
| C.加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-) +c(ClO-) =c(Na+) |
| D.通入过量Cl2,①、②均向右移动,溶液pH减小 |
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O和18O的物理性质和化学性质完全相同 |
| B.通过化学反应可以实现16O与18O的相互转化 |
C.向2SO2(g)+ O2(g)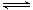 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
下列说法不正确的是
| A.任何化学反应都伴随着能量变化 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.离子化合物中一定含有离子键,可能含有共价键 |
| D.强电解质与弱电解质的区别就是电解质在水溶液中是否完全电离 |
下列说法中不正确的是
① 铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
② 汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③ 用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤ 明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
| A.②③⑤ | B.①②④ | C.③④⑥ | D.③④⑤ |