下列离子方程式书写正确的是
| A.向CuCl2溶液中加入少量氨水:Cu2++2OH一=Cu(OH)2↓ |
| B.向海带灰的浸出液中(酸性)加入双氧水制取I2:2I一+H2O2+2H+=I2+2H2O |
C.足量稀硫酸与氢氧化钡溶液混合:Ba2++OH一+SO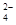 +H+=BaSO4↓+H2O +H+=BaSO4↓+H2O |
| D.铝溶于氢氧化钠溶液:2Al+2OH一+3H2O=2[Al(OH)4]一+3H2↑ |
已知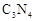 晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于
晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于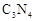 晶体说法错误的是
晶体说法错误的是
| A.该晶体属于原子晶体,其化学键比金刚石更牢固 |
| B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,原子间都是非极性键 |
在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为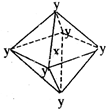
| A.NaCl | B.CsCl | C.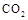 |
D.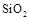 |
下列各有机物的名称肯定错误的是
| A.4-甲基-2-戊烯 | B.3-甲基-2-丁烯 |
| C.2,2—二甲基丙烷 | D.3-甲基-1-丁烯 |
下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.镁型和铜型的原子堆积方式空间利用率最高 |
| C.金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D.温度升高,金属的导电性将变大 |
关于CS2、SO2、NH3三种物质的说法中正确的是
| A.CS2在水中的溶解度很小,是由于其属于极性分子 |
| B.SO2和NH3均易溶于水,原因之一是它们都是极性分子 |
| C.CS2为非极性分子,所以在三种物质中熔沸点最低 |
| D.NH3在水中溶解度很大只是由于NH3分子有极性 |