A、B、C、D、E是5种短周期元素,其原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,E与B处于同一族,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.元素B、C、D具有相同电子层结构的离子,其半径依次增大
B.元素A不能与元素B形成化合物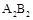
C.元素B、E分别与元素A形成的化合物的热稳定性: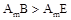
D.元素D、E的最高价氧化物的水化物都是强酸
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的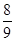 (同温同压下),此时N2、O2、CO2的物质的量之比为
(同温同压下),此时N2、O2、CO2的物质的量之比为
| A.1∶1∶0 | B.6∶9∶0 |
| C.3∶4∶1 | D.3∶3∶2 |
下列说法中不正确的是
| A.分散质粒子的直径为纳米级者(1nm~100nm)的分散系是胶体。 |
| B.胶体可通过过滤的方法从溶液中分离出来。 |
| C.氢氧化铁胶体可以稳定存在的原因是胶粒带正电荷。 |
| D.利用丁达尔现象可以区别溶液与胶体。 |
经分析某物质只含有一种元素,则此物质
| A.一定是一种单质 | B.一定是纯净物 |
| C.一定是混合物 | D.可能是纯净物,也可能是混合物 |
下列物质中既不属于碱性氧化物,与酸反应又能够生成盐和水的氧化物是
| A.Na2O | B.Na2O2 | C.Na | D.CuO |
将4、6gNa投入到95、4g水中,所得溶液中溶质的质量分数
| A.等于4、6% | B.等于8、0% |
| C.小于8、0% | D.大于8、0% |