某温度下,反应SO2(g)+ O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+ 3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
100℃时。下列三种溶液:①0.001 mol·L-1氨水与0.001 mol·L-1HCl溶液等体积混合液②pH=3的HCl与pH=11的NaOH溶液等体积混合液 ③pH=11的氨水与pH=1的HCl溶液等体积混合液。其中呈酸性的是
| A.① | B.③ | C.②③ | D.①③ |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是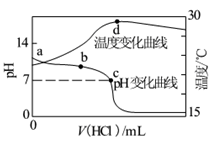
| A.氨水的电离程度a>b>c |
| B.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| C.c点时消耗盐酸体积V(HCl)<20 .00ml |
| D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热 |
用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
| A.盛装标准液的滴定管未用标准液润洗 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡 |