下列实验装置设计正确、且能达到目的的是
| A.实验I:检查装置的气密性 |
| B.实验II:测定未知盐酸的浓度 |
| C.实验III:比较硫、碳、硅三种元素的非金属性强弱 |
| D.实验IV:定容 |
下列离子方程式书写正确的为
| A.将氨气通入盐酸中:NH3 + HCl ="=" NH4+ + Cl- |
| B.铁与盐酸反应:Fe + 2H+ = Fe3+ + H2↑ |
| C.氯化钙溶液与碳酸钠溶液混合:Ca2+ + CO32—= CaCO3↓ |
| D.氢氧化钡溶液与稀硫酸混合:Ba2+ + SO42—= BaSO4↓ |
下列物质之间的转化符合:“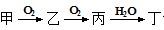 ”的组合是
”的组合是
①Na→NaOH;②Cu→Cu(OH)2;③S→H2SO4;④NH3→HNO3
| A.①②③ | B.①③④ | C.②③④ | D.全部 |
下列关于氯气的叙述中不正确的是
| A.可用向上排空气法收集少量的氯气 |
| B.与水反应生成的次氯酸是一种弱酸 |
| C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA |
| B.标况下,11.2L SO3所含的分子数目为0.5 NA |
| C.甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D.1 mol C2H6O分子中含有的O—H键数目一定为NA |
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为
| A.48 | B.28 | C.32 | D.4 |