二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
① 由表中数据判断ΔH 0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
② 某温度下,将 2mol CO和 6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。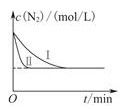
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
(选做题)某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由右图中数据分析: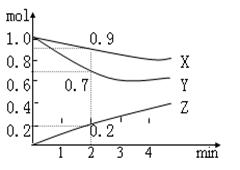
(1)反应开始2min内的X的化学反应速率
(2)该反应的化学方程式为:___________。
(选做题)针对下图所示乙醇分子结构,乙醇与金属钠反应时, ___键断裂;乙醇在铜催化下与氧气反应时,________键断裂。
(选做题)有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是__ W是__ X是__ Y是__
(选做题)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+。这个变色的过程中的Fe2+被(填“氧化”或“还原”)。若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有:。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力。其结构简式为
请回答:
(1)维生素C的分子式是,其分子中不含氧的官能团的名称是。
(2)维生素C可发生的化学反应有(填序号)。
①加成反应②氧化反应③酯化反应
(3)向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水溶液显性。