某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.SO42-、NH4+一定存在,Cl-可能不存在 |
| B.至少存在5种离子 |
| C.CO32-、Al3+一定不存在,K+可能存在 |
| D.Cl-一定存在,且c(Cl‑)≥0.4mol/L |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
下列各变化中属于原电池反应的是()
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面锌有划损时,也能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是
A.A池为电解池,B池为原电池 B.D、E两极都发生氧化反应
C.F极应为粗铜板材料 D.B池中E极质量增加12.8g
在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)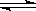 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是
| A.容器内压强不随时间变化 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 |
| D.单位时间消耗0.1mol X同时生成0.2mol Z |
用铜片、银片、Cu(NO3) 2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池(如图)。以下的叙述正确的是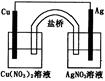
①在外电路中,电流由铜电极流向银电极②正极反应为:Ag+ + e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |