李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜(如下图),反应的化学方程式为:C+2CuO高温 2Cu+CO2↑,他联想到单质碳的一些化学性质,认为在该实验中还可能会有CO产生。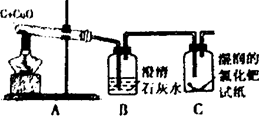
查阅资料:CO气体能使湿润的黄色氯化钯试纸变蓝色。
实验验证:
(1)点燃A处酒精灯,数分钟后发现试管中的黑色固体物质变红,该红色物质是___________;
(2)装置B中发生的实验现象是__________________________,
该反应的化学方程式是___________________________;
(3)C装置中湿润的黄色氯化钯试纸变蓝色,说明有______气体生成,证明李洋同学是判断是正确的。
实验反思:
(4)李洋同学对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO高温 2Cu+CO2↑中的一种产物和反应物木炭又发生了新的化学反应,产生了CO;
③原因三:……
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理:
_____________________________ _____________。
(5)在设计装置时还要考虑环保因素,因此要在装置C处添加__ _________装置。
化学与生活联系密切,生活中处处有化学。
(1)食醋不慎滴在厨房大理石台面或水泥地面上,立即发出“嘶嘶”响声,并冒气泡,这是因为发生了
变化(填“物理”或“化学”)。
(2)市场上调味品种类丰富,有碘盐、钙盐、加铁酱油等,其中含有的碘、钙、铁三种元素中属于非金属元素的是。(填元素符号)
(3)长期饮用硬水对人体健康不利,生活中可用来区别硬水和软水。
(4)农村一些家庭用“沼气”做燃料,沼气的主要成分是甲烷(CH4)。写出甲烷完全燃烧的化学方程式。
控制化学反应的条件可以促进或抑制化学反应,更好使化学反应为人类造福.
(1)元素周期表中铝元素的信息如图所示,其相对原子质量为.
化学反应中该原子容易(填“得到”或“失去”)电子;
(2)铝元素在自然界中主要以 Al2O3存在,Al2O3属于(填字母序号).
| A.单质 | B.氧化物 | C.金属 | D.混合物 |
(3)工业用电解熔融 Al2O3的方法冶炼铝,化学方程式为2Al2O3 4Al+3O2↑,属于基本反应类型中的反应.
4Al+3O2↑,属于基本反应类型中的反应.
天然水受到污染后,净化时需要运用科学的方法。
(1)天然水污染的来源有____________;常用的净水方法有____________(各写出一种即可)。
(2)漂白粉可用水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应:Ca(ClO)2+X+H2O=CaCO3↓+2HClO,则X的化学式为___________。次氯酸钙中氯元素的化合价是____________。
(3)水是生命之源,也是人类最宝贵的资源。用你学过的化学知识回答下列问题:
①某同学在完成电解水实验时,发现正极产生了20 mL气体,则负极产生的气体体积是。该实验能够说明水是由氢元素与氧元素组成的依据是
②硬水可用来检验,生活中可用来降低水的硬度。
③硬水在加热或久置时,铝壶中会产生水垢[主要成分含有CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式。
④在潮湿时,铁制品易生锈,可用适量稀盐酸除去,写出有关反应的化学方程式。
(4)大气是大自然对人类的恩赐,与人类的生存休戚相关。
①将空气中的二氧化碳通入紫色的石蕊试液,紫色石蕊试液变红的原因是。
②“节能减排”是我国的重要国策,过多的CO2排放会造成效应。
③能源问题是当今世界三大问题之一,下列有关能源的叙述中不正确的是。
| A.乙醇汽油中添加的乙醇属于可再生能源 |
| B.人类通过化石燃料获得能量的过程是物理变化 |
| C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分 |
| D.我国南海海底储藏了大量“可燃冰”,它将成为替代化石燃料的新能源 |
(1)化学用语可准确、简洁地记录、表达和交流化学信息。请用化学符号填写:
①保持乙醇的化学性质的最小粒子 ;
②由地壳中含量最多的金属元素原子形成的离子。
(2)在H、O、C、Cl、N、Na、Ca七种元素中,选择适当的元素组成符合下列要求的物质,将其化学式填入空格内:
①约占空气总体积五分之四的气体;②固体可用于人工降雨的物质;③天然气的主要成分;④能使紫色石蕊试液变红色的物质;(写一种)
(3)下图中的Ⅰ、Ⅱ分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图。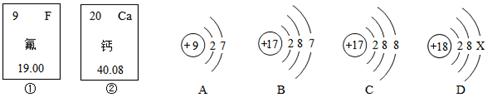
根据题中信息回答:
①钙原子的核电荷数为;
②X=;A、B、C、D中属于同种元素的粒子是(填序号);
③A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似(填序号)。
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为________________________________;
【查阅资料】
碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量样品溶于水,加入 ; |
白色沉淀产生 |
该反应的化学方程式为 |
| (2)将上述反应后的混合液过滤,取滤液加入; |
证明猜想Ⅱ成立。 |