(8分)当硝酸与金属或非金属反应时,反应物或反应条件不同,硝酸被还原的产物也不同。
请回答下列问题:
(1)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、_______、NH2OH、NH4+。(填化学式)。
(2)某混酸由200 mL 3 mol·L-1的稀硝酸和200 mL 2.5 mol·L-1的稀硫酸均匀混合而成(忽略溶液的体积变化)。将其与铁反应,还原产物只有NO,则最多能溶解_______ g Fe。
(3)200 mL 16 mol·L-1的浓硝酸与64 g Cu恰好完全反应,反应过程中还原产物有NO、NO2,则反应结束后,产生气体的体积为_________L(标准状况下) (忽略HNO3的挥发)。
(本题共12分)下表是四种盐在不同温度下的溶解度(g/100g水):
| NaNO3 |
KNO3 |
NaCl |
KCl |
|
| 10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
| 100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
36、在①和②的实验过程中,需要控制的关键的实验条件是______________________,
在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
37、在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
38、粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
39、为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
40、如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
(本题共8分)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
32、能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
33、下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
34、要提高CO的转化率,可以采取的措施是________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
35.寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
(本题共8分)铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
28、若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式。
29、向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是(写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+
若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是mol。
30、由以上实验,推断Fe2+、S2—和SCN—的还原性强弱(按从强到弱顺序排列)。
31、向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向
(本题共8分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
| J |
||||
| R |
M的气态原子逐个失去1~ 4个电子所需能量(电离能)如下表所示,
| I1 |
I2 |
I3 |
I4 |
…… |
|
| 电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
…… |
23、M的电子排布式为________;元素T在周期表中的位置为________。
24、J和氢能形成多种化合物,其中分子成直线型的,且相对分子质量最小的物质的结构式为________。
25、M和T形成的化合物在潮湿的空气中冒白雾,反应的化学方程式为_________________。
26、由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为________。
27、能源材料已成为当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为。
②下列叙述不正确的是。(填字母)
A.因为HCHO为极性分子,水也为极性分子,根据相似相溶原理,HCHO易溶于水。
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个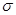 键和1个大
键和1个大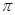 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A.共价键 B.非极性键 C.配位键D.σ键 E.π键
写出一种与 CN-互为等电子体的单质分子式。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于区。
(4)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题: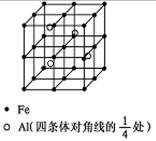
① 确定该合金的化学式。
② 若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为cm。