工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 molCH4和1.2 molNO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 |
时间/min n/mol |
0 |
10 |
20 |
40 |
50 |
| T1 |
n(CH4) |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| T2 |
n(CH4) |
0.50 |
0.30 |
0.18 |
…… |
0.15 |
下列说法不正确的是
A.10 min内,T1时υ(CH4)比T2时小
B.温度:T1<T2
C.ΔH:a<0
D.平衡常数:K(T1) <K(T2)
某有机物的结构简式如图所示,其名称正确的是()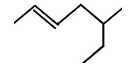
| A.5-乙基-2-己烯 | B.3-甲基庚烯 |
| C.3-甲基-5-庚烯 | D.5-甲基-2-庚烯 |
一次区分乙酸、乙醇、苯、四氯化碳四种液体的试剂是()
| A.H2O | B.溴水 | C.新制Cu(OH)2 | D.酸性高锰酸钾溶液 |
以下有机反应类型:①取代反应②加成反应③消去反应④酯化反应⑤加聚反应⑥还原反应,其中可能在有机分子中新产生羟基的反应类型是()
| A.①②③ | B.①④⑥ | C.①②⑥ | D.②④⑤ |
下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是()
| A.丙烷 | B.丙酮 | C.乙醛 | D.甲酸乙酯 |
主链含有5个碳原子,有甲基、乙基两个支链的烷烃有()
| A.2种 | B.3种 | C.4种 | D.5种 |