【化学选修——有机基础化学】
醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如图。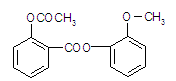
回答下列问题:
(1)醋柳酯的分子式为 。
(2)关于醋柳酯的说法中,正确的是( )
| A.是高分子化合物 |
| B.可与氢气发生加成反应 |
| C.不能发生银镜反应 |
| D.能发生水解反应且只生成2种有机物 |
(3)醋柳酯可由下图所示路线合成: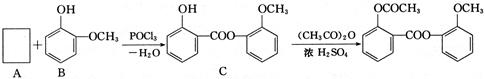
①A的含氧官能团名称为 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是 。
②由C制醋柳酯的反应类型为 ;写出C和足量NaOH溶液反应的化学方程式 。
③A的同分异构体很多,写出一种属于酯类、且能与FeCl3溶液反应显紫色的同分异构体的结构简式 。
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为:  (其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
(其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
已知向D的水溶液中滴入FeCl3溶液显紫色,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物只有两种。
(1)D中含氧官能团名称,B→E的反应类型为;
(2)B和G在一定条件下可反应生成六元环状化合物的化学方程式:;
(3)X可能发生的反应有:(填字母标号)
| A.加成反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(4)D有多种同分异构体,其中核磁共振氢谱中只有4种峰的同分异构体的结构简式为:(任写两种)。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的该反应的反应速率为:,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 
①该电池正极的电极反应为。
② 用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为(填名称)。
乙烯和溴水反应主要生成A,同时还有B和溴乙烷生成。各物质的转化关系如下图。
已知:E的结构简式为 ,I的分子式为C4H4O4,是一种环状化合物。
,I的分子式为C4H4O4,是一种环状化合物。
请回答下列问题:
(1) E的分子式是_______;B的结构简式是___________________
(2) 在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是
_______,名称是______________
(3) 在反应①〜⑩中,属于取代反应的是⑥和_______(填写编号);
(4) 写出反应⑩的化学方程式__________ ___________
___________
(5) J是I的同分异构体,且1 mol J与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出一种符合条件J的结构简式_______
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V 型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
请回答下列问题(填空时用实际符号):
(1) C的元素符号是;元素 F在周期表中的位置。
F在周期表中的位置。
(2) B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为,其固体时的晶体类型是。
(3) 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右所示。科学家最近又用脉冲激光烧蚀CCl4又发现了C2分子。根据以上信息,下列说法正确的是。
① C4属于一种新型的化合物
② C4沸点比P4(白磷)低
③ C4与C2互为同素异形体
④ C4稳定性比P4(白磷)差
⑤ C4属于原子晶体
⑥ C4和P4 (白磷)的晶体都属于分子晶体
⑦ C4与C2互为同分异构体
(4) C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为,其空间构型为。
(5) 为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6) E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是。
a .E2F2的结构式为:F- E—E- F
b. E2Br2与E2F2结构相似,熔沸点:E2Br2 < E2F2
c. E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如下:
⑴侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)、。
⑵合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:、。(填化学式)这两种气体在使用过程中是否需要考虑添加的顺序:(填“是”或“否”),原因是: 。
。
⑶在沉淀池中发生的反应的化学方程式是:。
⑷使原料水中溶质的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环。从母液中可以提取的副产品的应用是(举一例)。