(1)写出下图中序号①~③仪器的名称:
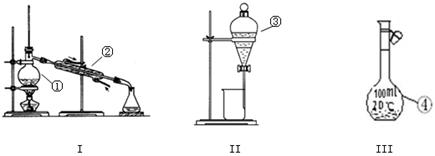
① ;② ;③ 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现用该浓硫酸配制480 mL 1 mol· L-1的稀硫酸。
可供选用的仪器有:①胶头滴管②烧瓶③烧杯④ 玻璃棒⑤药匙⑥量筒⑦托盘天平。
请回答下列问题:
a.该硫酸的物质的量浓度为 mol· L-1。
b.配制稀硫酸时,还缺少的仪器有 (写仪器名称)。
c.经计算,配制480mL 1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为__ mL。
d.对所配制的稀硫酸进行测定,发现其浓度大于1 mol· L-1,配制过程中下列各项操作可能引起该误差的原因有 。
| A.定容时,俯视容量瓶刻度线进行定容 。 |
| B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。 |
| C.转移溶液时,不慎有少量溶液洒到容量瓶外面。 |
| D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水 。 |
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
1.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是、
(2)下列有关配制过程中说法错误的是(填序号)。
A用电子天平称量质量为1.944g的FeBr2.
B将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
D.容量瓶贴签存放配好的FeBr2溶液
E.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;假设2:Fe2+被Cl2氧化成Fe3+。
(1)请你完成下表,验证假设:
| 实验步骤、预期现象 |
结论 |
| ①溶液中加入适量四氯化碳, |
假设1正确 |
| ②向溶液中加入 |
假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是 ____________;
(2)实验证明:还原性Fe2+> Br-,请用一个离子方程式来证明: _________________;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,反应的离子方程式为。
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
[实验1]铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验: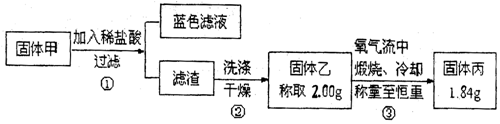
(4)②中检验滤渣是否洗涤干净的实验方法是
(5)③中在煅烧过程中一定发生的反应的化学方程式为。
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32+、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
(1)待测液中是否含有SO42-、SO32-:。
(2)沉淀B的化学式为;生成沉淀B的离子方程式为。
(3)根据以上实验,待测液中肯定没有的离子是;
肯定存在的离子还有。
I、下列物质中属于强电解质的是;属于弱电解质的是;属于非电解质的是。(填序号)①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是Cr2(SO4)3是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g) +2B(s)
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压②增大A的浓度③增大C的量
④升温⑤降温⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。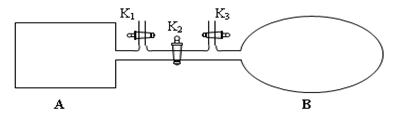
①B中可通过________________判断可逆反应2NO2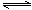 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______(填 “变大”“变小”或“不变”)。
③若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。