为提纯下列物质(括号内物质为杂质),所选用的试剂、除杂和分离方法均正确的是
| 物质 |
除杂试剂 |
除杂和分离方法 |
|
| A |
乙醇(水) |
—— |
分液 |
| B |
铝粉(镁粉) |
NaOH溶液 |
过滤 |
| C |
CO2(CO) |
O2 |
点燃 |
| D |
CO(CO2) |
NaOH溶液 |
洗气 |
关于氧化还原反应下列叙述正确的是
| A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B.在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| C.阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D.非金属单质在氧化还原反应中可能做氧化剂也可能做还原剂 |
下列物质的转化能实现的是
A.Na Na2O Na2O Na2O2 Na2O2 |
B. |
C.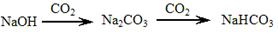 |
D.Fe FeCl2 FeCl2 FeCl3 FeCl3 |
分类是化学研究中常用的方法。下列分类方法正确的是
| A.根据溶液酸碱性,将化合物分为酸、碱、盐 |
| B.根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液 |
| C.根据水溶液是否导电,将化合物分为电解质和非电解质 |
| D.根据化合物是否来自于有机体,将化合物分为有机物和无机物 |
下列关于实验室制取氯气的说法正确的是
| A.盛浓盐酸的分液漏斗可用长颈漏斗代替 |
| B.为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
| C.可用饱和食盐水吸收尾气 |
| D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 |