利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。含有农药、染料、酚、氰化物,具有臭味的废水,常用氧化法进行处理。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-离子)的废水。在碱性条件下(PH=8.5~11),氯气可将氰化物中CN-氧化为比它毒性小1000倍的氰酸盐(含CNO-)。
(1)写出含CN-废水中用氯气氧化,生成氰酸盐时的离子方程式 。
(2)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,写出反应的离子方程式 。
(3)ClO2也可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2氧化除去CN-的离子方程式 。ClO2消毒(氧化)效率是同质量消毒剂NaClO的 倍 。(保留2位小数)
(4)某同学欲对用ClO2消毒过的水进行Cl-含量的测定。实验过程如下:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001000 mol/L AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达到滴定终点,此时用去AgNO3溶液12.12 mL ,则:
①水样中Cl-的物质的量浓度是 ;
②如在滴定终点时,测得溶液中的CrO42-浓度是3.000×10 -3 mol/L,则此时溶液中Cl-的浓度为 。(已知KSP(AgCl)=" 1.77×10" -1 0, KSP(Ag2CrO4) = 2.70×10-1 2 )
(5)(CN)2被称为拟卤素,CN-则被称为拟卤离子,它们的性质类似于卤素单质(如氯气)及卤素阴离子(如氯离子)。
①写出(CN)2与NaOH溶液反应的离子反应式 。
②写出CN-的电子式 。
③已知1g气态(CN)2完全燃烧放出21.1kJ的热,写出(CN)2 (g) 在O2 (g) 中燃烧的热化学反应方程式 。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为;除去NaCl溶液中的SO42-,可依次加入、 和三种溶液。
和三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
写出反应②③的化学反应方程式:,。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e—→NO+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
下表中列出五种短周期元素A、B、C、D、E的 信息,请推断后作答:
信息,请推断后作答:
| 元素 |
有关信息 |
| A |
元素主要化合价为—2,原子半径 为0.074 n m 为0.074 n m |
| B |
所在主族序 数与所在周期序数之差为4 数与所在周期序数之差为4 |
| C |
原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D |
最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
| E |
原子半径为0.075 n m,最高价氧化物的水化物 与其氢化物组成一种盐X 与其氢化物组成一种盐X |
(1)画出B的离子结构示意图;写出D元素最高价氧化物的水化物电子式
(2)盐X水溶液显(填“酸”“碱”“中”)性,用离子方程式解释其原因
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是
(5)如右图是一个电解过程示意图。
假设使用Y-空气燃料电池 作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中
作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中 氧气的体积含量为20%)L
氧气的体积含量为20%)L
(16分)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛 应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为▲ ,每生成1molNF3,转移的电子数为 ▲ ,生成物NF3中氮原子的杂化方式为 ▲ ,NF3分子空间构型为▲;
▲ ,生成物NF3中氮原子的杂化方式为 ▲ ,NF3分子空间构型为▲;
(2)N、F两种元素的氢化物稳定性比 较,NH3 ▲HF(
较,NH3 ▲HF( 选填“>”或“<”);
选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式 ▲;
(4) 氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子, 写出该反应的化学方程式▲ ;
(5)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如左图,该离子化合物的化学式为 ▲。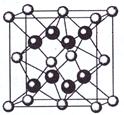
(12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为▲ (填编号);
a.过量铁屑和稀硫酸b.过量稀硫酸和铁屑c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 |
① |
② |
③ |
| 加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
| 红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
⑶在烧杯②中加入2种试剂后,即可观察到的现象为▲ ;
⑷通过比较上述3组实验,可以得出的结论为▲ ;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①试用一个离子方程式表示上述反应过程中的变化▲ ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因▲ 。