一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)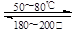 Ni(CO)4(g) 该反应的ΔH 0(选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH 0(选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH3= 。
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:v(CH3OH)= ;生产过程中,合成气要进行循环,其目的是 。
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。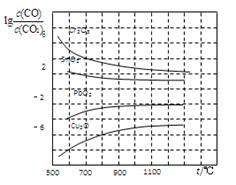
则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K= 。800℃时,其中最易被还原的金属氧化物是 (填化学式),该反应的平衡常数数值(K)等于 。
(每空2分,作图3分,共13分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是Al3+和________,阴离子是________。
(2)试通过计算确定:n(Al3+)=________;该结晶水合物的化学式________。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol/L。
①加入mLBa(OH)2溶液时,所得沉淀的总物质的量最大。
②请在下图中画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图。
(每空2分,共12分)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是(写化学式)。
(2)写出并配平该反应的化学方程式:
(3)发生氧化反应的物质是,反应中4mol的氧化剂能(填“失去”或
“得到”)mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为。
(每个方程式2分,其余每空1分,共8分)现有下列物质:①KI②铜③稀硝酸④NH3⑤NaHSO4 ⑥Ba(OH)2⑦氢氧化铁胶体⑧氨水
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 |
电解质 |
盐 |
非电解质 |
混合物 |
| 属于该类的物质 |
(2)上述某两种物质在溶液中可发生离子反应:H++OH-= H2O,写出该离子反应对应的化学方程式。
(3)物质①的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为。
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为
。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(5)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。在加热条件下用液态肼(N2H4)还原新制Cu(OH )2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为 3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 。
【化学 ― 选修 3 物质结构与性质】
氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为。
(2)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为形,阳离子中氮的杂化方式为。
(3)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),工业制备 X 的化学方程式为。
(4)X晶体中包含的化学键类型为(填字母标号)。
| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,其原因是。
(6)若X的密度为ρg/cm3,则晶体中最近的两个Al 原子的距离为cm (阿伏加德罗常数用 NA表示,不必化简)。