工.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,
溶液中 (填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_________
(填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_________
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHC1溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为
②已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= 。
Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L(已知25℃时,Ksp[Cr(OH) 3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度_______(单位:mg/L,写出计算过程)。 已知测定过程中发生的反应如下:
①2Cr3++3S2O32-+7H2O= Cr2O72-+6SO42-+14H+ ②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+ S2O32-= 2I-+ S4O62-
在一定温度下,把2 mol SO2和1 mol O2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2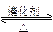 2SO3。当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c、分别代表初始加入的SO2、O2和SO3的物质的量(摩)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
2SO3。当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c、分别代表初始加入的SO2、O2和SO3的物质的量(摩)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,c=_____________。
(2)若a=0.5,则b=_____________和c=____________。
(3)a、b、c取值必须满足的一般条件是(用两个方程式表示,其中一个只含a和c,另一个只含b和c):_____________,______________。
恒压(1.01×105 Pa)下,将2.0 mol SO2与a mol O2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)="1.3" mol,n(O2)="3.0" mol,则a=_______________;平衡时SO2的转化率为__________________。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8 mol。T1与T2的关系是___________(选填序号)。
①T1>T2②T1<T2③T1=T2
一定条件下,在容积为2 L的密闭容器中将2 mol 气体N和3 mol气体M混合,发生如下反应:
2N(g)+3M(g) xQ(g)+3R(g),当反应达到平衡时,生成2.4 mol气体R,并测得Q的浓度为0.4 mol·L-1。x的值为_________,N的转化率为_________。
xQ(g)+3R(g),当反应达到平衡时,生成2.4 mol气体R,并测得Q的浓度为0.4 mol·L-1。x的值为_________,N的转化率为_________。
在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b%。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol N2,反应达平衡时有3a mol NH3生成,N2的转化率仍为b%。则x=______;y=______。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达平衡时N2转化率仍为b%,则x、y的关系为______;z的取值范围为______。
(3)在恒温〔与(1)温度相同〕和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时N2的转化率为c%,则b、c的关系为(用“<”“=”或“>”表示),理由是_______________。
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是___________________________。
C(g)+D(g)已达平衡的是___________________________。
①混合气体的压强②混合气体的密度③B的物质的量浓度④气体的总物质的量