下列叙述正确的是
| A.硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.常温下,等物质的量浓度的(NH4)2CO3和Na2CO3溶液,前者的c(HCO3-)小 |
| C.NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D.等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH 降低,应采取的措施是
| A.加热 | B.加少量水 | C.加少量盐酸 | D.加少量醋酸钠晶体 |
相同体积的PH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
| A.无法比较两者产生氢气的量 | B.两者产生等量的氢气 |
| C.强酸溶液产生较多的氢气 | D.弱酸溶液产生较多的氢气 |
已知溶液中存在Cr2O72-+ H2O 2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
| A.黄色加深 | B.橙色加深 | C.颜色不变 | D.颜色褪去 |
对于可逆反应,2SO2 (g)+ O2(g) 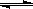 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
| A.增大SO2的转化率K值一定增大 | B.减小压强K值减小 |
| C.K值越大SO2转化率越大 | D.升高温度K值增大 |
在密闭容器中一定量混合气体发生反应:x A (g) + y B(g) ≒ z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的 容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/L,下列判断正确的是
容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/L,下列判断正确的是
| A.x+y >z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数保持不变 |