下列叙述正确的是
| A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 |
| C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2 |
| D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
下列物质久置空气中(不考虑水分蒸发或吸收空气中的水分)变质,且能析出固体,加入盐酸时固体不溶解的是( )
| A.澄清石灰水 |
| B.水玻璃(Na2SiO3) |
| C.氢硫酸 |
| D.氯化钙 |
X、Y两元素能以共价键结合成化学式为XY2的物质,则X、Y两元素可能分别属于元素周期表中的族是( )
| A.ⅠA和ⅤA |
| B.ⅣA和ⅥA |
| C.ⅡA和ⅥA |
| D.ⅠA和ⅥA |
下列离子方程式正确的是( )
| A.NaF溶液中通入足量的CO2气体: F-+CO2+H2O====HF+  |
B.NaHCO3溶液中滴入少量的石灰水: +OH-+Ca2+====CaCO3↓+2H2O +OH-+Ca2+====CaCO3↓+2H2O |
| C.石灰水中滴入少量的NaHCO3溶液: 2  +2OH-+Ca2+====CaCO3↓+ +2OH-+Ca2+====CaCO3↓+ +2H2O +2H2O |
| D.SiO2溶于NaOH溶液中: |
SiO2+2OH-====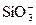 +H2O
+H2O
下列关于硅的叙述正确的是( )
| A.硅是非金属元素,但是它的单质是灰黑色有金属光泽的固体 |
| B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 |
| C.硅的化学性质不活泼,常温下不与任何物质起反应 |
| D.硅与氟、氯、溴、碘在加热条件下也不能直接化合 |
在一定条件下,既能跟二氧化碳反应,又能跟二氧化硅反应的物质是( )
| A.Na2CO3溶液 | B.浓H2SO4 |
| C.NaOH溶液 | D.碳 |