(14分)某蓄电池的反应为NiO2+Fe+2H2O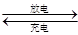 Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是________(填下列字母)。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体镶嵌Zn块,或与该蓄电池的______极(填“正”或“负”)相连。
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示) _____________________,_____________________________________。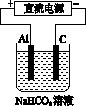
(4)精炼铜时,粗铜应与直流电源的______极(填“正”或“负”)相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案: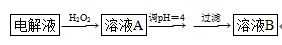
已知:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
| 完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是___________________。
乙同学认为应将方案中的pH调节到8,你认为此观点____________(填“正确”或“不正确”),理由是______________________________________________。
(8分) SiC又叫金刚砂,是砂轮的主要成分,可看着是金刚石里一半碳原子被硅原子替换的产物。
①工业上用焦炭和石英在高温下反应制得SiC:3C+SiO2 SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
②SiC晶体中有两个含五个原子的基本结构单元,分别是和。
③SiC晶体中最小的原子环是圆环,该环独立有个Si原子,个C原子。
④1molSiC晶体中含mol Si-C键。
⑤金刚石、SiC晶体、晶体Si 熔点由高到低的顺序。
已知NiXO晶体晶胞结构为NaCl型(见19题图),由于晶体缺陷,x值于小于1。测知NiXO晶体密度ρ
 为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4"
为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4" 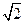 =1.4)
=1.4)
(1)晶胞中两个Ni原子之间的最短距离___________(精确至0.01)。
(2)与O2-距离最近且等距离的Ni离子围成的几何体形状_______
(3)求NiXO中x值为_________(精确至0.01)。
(4)晶体中的Ni分别为Ni2﹢、Ni3﹢,求此晶体的化学式_________。
原子序数由小到大排列的X、Y、Z三种短周期元素,已知三种元素的原子序数之和等于16,单质X2 、Y2 、Z2之间有如下转化关系(反应条件已略)。已知:甲、乙分子中均含有10个电子;丙分子中含有15个电子。请回答: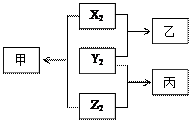
(1)Y2的电子式是_________;该分子中有个σ键,个π键。
(2)甲属于(填“极性”或“非极性”)分子;晶体中甲分子的配位数为 。
。
(3)乙分子的VSEPR模型名称为,分子的立体构型名称为。
(4)写出乙与Z2反应生成丙的化学方程式。
(5)工业上用氧化铝、碳和乙在1400℃条件下反应,制取由元素Y和Al组成的化合物丁,同时还有CO和X2生成。已知反应中消耗1mol乙,可生成1.5molCO和1.5molX2。写出反应的化学方程式:,氧化剂为。
已知T、X、Y、Z是四种常见的短周期元素,其结构或性质信息如下表。请填空:
(1)写出与Y2互为等电子体的物质的分子式。
(2)写出Y的最简单气态氢化物的结构式。
(3)元素Q的原子序数比X与Z的原子序 数之和还多1。
数之和还多1。
①该元素基态原子的价电子排布式为 。
。
②向含Q离子的水溶液中逐滴加入Y的简单氢化物的水溶液至过量,写出有关反应的离子方程式、。
随着科学技术的不断发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:①将NaCl固体细粒干燥后,准确称取m g NaCl固体细粒并转移到定容仪器A中;②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。请回答:
(1)步骤①中仪器A最好使用(填序号)。
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管,理由是。
(3)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则用上述方法测得的阿伏加德常数NA的表达式为。(NaCl的相对分子质量用M表示)