某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+、AlO2-和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中A
| A.至少存在4种离子 |
| B.Clˉ一定存在,且c(Clˉ)=0.4mol·L-1 |
| C.SO42ˉ、NH4+一定存在,AlO2-可能存在 |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
同温同压下,在两个密闭容器中分别充有质量相同的甲、乙两种气体,且甲的密度大于乙的密度。则下列说法正确的是
| A.甲的物质的量比乙的物质的量少 | B.甲气体所占体积比乙气体所占体积大 |
| C.甲相对分子质量比乙相对分子质量小 | D.甲气体摩尔体积比乙的气体摩尔体积小 |
关于O2与O3气体,下列比值一定为2:3的是
| A.若两种气体所占体积相同,两种气体的质量之比 |
B.若温度及压强相同 ,两种气体的密度之比 ,两种气体的密度之比 |
| C.若两种气体原子数相同,两种气体的质子数之比 |
D.若两 种气体的质量相同,两种气体的分子数之比 种气体的质量相同,两种气体的分子数之比 |
下列反应中,电子 转移方向和数目正确的是
转移方向和数目正确的是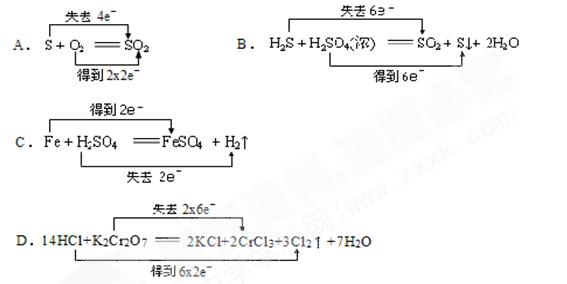
下列实验操作中正确的是
| A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
| B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
下列关于分散系的叙述不正确的是
A.胶体区别于其他 分散系的本质特征是分散质的微粒直径在10-9 - 分散系的本质特征是分散质的微粒直径在10-9 - 10-7m之间 10-7m之间 |
| B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 |
| C.把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 |
| D.树林中晨曦的阳光束现象与丁达尔现象有关 |