(16分)海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
NA+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg﹒L-1 |
9360 |
83 |
200 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示) ,该海水中Ca2+的物质的量浓度为 mol/L。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。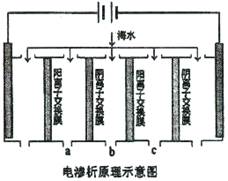
①阴极的电极反应式为 。
②电解一段时间,阴极区会产生水垢.其成分为CaO3和Mg(OH)2,写出生成CaO3的离子方程式 。
③淡水的出口为a、b、c中的 出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示: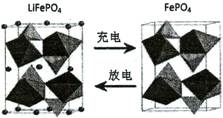
该电池电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),电极反应式为 。
(4)利用海洋资源可获得MnO2 MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程消耗相同条件下空气和氯气的体积比为 (空气中氧气的体积分数20%计算)。
在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入适量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为正四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式________________________________,四碘化二磷的磷的化合价为________,磷酸中磷的化合价为____________________,A中磷的化合价为____________________。
由短周期元素组成的A、B两种盐可发生变化,且B的焰色反应呈黄色(图中其他生成物未列出)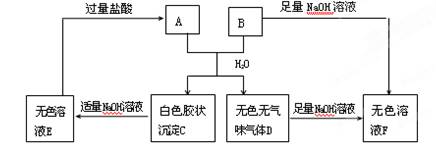
(1)无色溶液F中,一定含有的溶质的化学式为。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________________。
(3)A和B的混合物溶于水发生反应的离子方程式____________________________。
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的 离子方程式_________________________________________________________。
离子方程式_________________________________________________________。
(16分)(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):
;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性 ,原因是(用离子方程式表示):__________________
_ _________________________________________________ 。
_________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
. 用双线桥法表示下列化学反应中的电子转移情况,是离子反应的将其改写为离子方程式,不是离子反应的可不填.
(1) 加热硝酸铵
5NH4NO3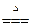 4N2↑+2HNO3+9H2O
4N2↑+2HNO3+9H2O
(2)在含有Na2S和Na2SO3的溶液中,加入稀硫酸
2Na2S+Na2SO3+3H2SO4==3Na2SO4+3S↓+3H2O
(3)铜片与稀硝酸反应
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO+4H2O
(12分)氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1 NaCl溶液。请回答问题。
| 实验步骤 |
有关问题 |
| (1)计算并称量 |
需要NaCl的质量为________g |
| (2)溶解 |
为加速溶解,可进行的操作是________ |
(3)转移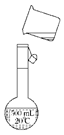 |
a. 指出示意图中的两处错误:错误1: _____________________ ________________________ ________________________ ____ ____错误2:___________________________________________ b. 若容量瓶不干燥,含有少量蒸馏水,会造成所配溶液的物质的量浓度 (填“偏高”“偏低”或“无影响”) |
| (4)定容 |
若仰视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度________(填“偏高”“偏低”或“无影响”) |