已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过下图所示的装置,得到如下表所示的实验数据(假设生成的气体全部被吸收)
| |
实验前 |
实验后 |
| 甲的质量/g |
101.1 |
103.8 |
| 乙的质量/g |
82.0 |
86.4 |
根据实验数据填空:
(1)该燃料完全燃烧生成CO2的质量为 g。
(2)该燃料分子中碳、氢原子的数目比为 。
(3)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为 ,其可能的结构简式为 。
石墨的片层结构如图所示,试回答: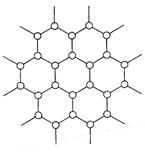
(1)平均个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与碳一碳化学键之比是。
(3)ng碳原子可构成个正六边形。
金属铜的晶胞是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子)。则金属铜平均每个晶胞中有__________个金属原子组成的。已知铜的摩尔质量是64g·mol—1,金属铜的密度是8.93g·cm-3。则金属铜的晶胞体积是。计算过程为:
将H2S、HF、HCl、HI、CH4、NH3、H2O、MgO、SiO2、CO2、SO2、NaCl、NaOH等化合物按以下要求填空:
(1)具有强极性键的弱酸是,具有强极性键的强酸是,具有弱极性键的强酸是,具有弱极性键的弱酸是,其水溶液有强碱性的是,其水溶液有弱碱性的是。
(2)属于离子化合物的是。
(3)属于分子晶体的氧化物是,属于原子晶体的氧化物是。
(4)具有正四面体构型的化合物是,难溶于水的气态氢化物是,难溶于水的氧化物是。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
在下列H2O、H2O2、Ba(OH)2、Na2O2、K2O等化合物中,由离子键和极性键构成的化合物是;由离子键和非极性键构成的化合物是;由极性键和非极性键构成的化合物是。