研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。
写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)测得CH3OH的物质的量随时间的变化见图。
CH3OH(g)+H2O(g)测得CH3OH的物质的量随时间的变化见图。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2、3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图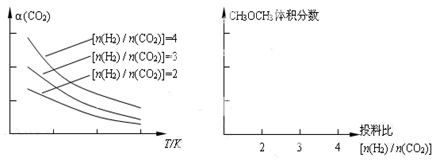
 芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO--COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO--COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号)_______________.
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰.
(2)E中含有官能团的名称是__________________.
(3)A有两种可能的结构,其对应的结构简式为________________、______________.
(4)B、C、D、F、G化合物中互为同系物的是_________________.
(5)F与H在浓硫酸作用下加热时发生反应的方程式为_________________________.
阿司匹林( )是应用最早、最广和最普通的解热镇痛药。科学家通过乙二醇把阿斯匹林连接在高聚物F上,制成缓释长效阿斯匹林(
)是应用最早、最广和最普通的解热镇痛药。科学家通过乙二醇把阿斯匹林连接在高聚物F上,制成缓释长效阿斯匹林( )。
)。
高聚物F的合成路线如下:
(1)阿司匹林中含有的官能团名称。
(2)A的名称为B的结构简式为_____________ 。
(3)阿斯匹林连接在高分子载体上的有机反应类型是; D→E的反应类型是。
(4)写出B→C反应的化学方程式:___________________;
写出E→F反应的化学方程式:___________________。
(5)阿司匹林可由水杨酸(C7H6O3)跟乙酸酐在催化剂作用下生成,满足以下条件的水杨酸的同分异构体有多种,写出其中任一种的结构简式。
①分子中有苯环;②能发生银镜反应;③苯环上的一硝基取代物有2种。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为_______________,砷与溴的第一电离能较大的是______.
(2)AsH3是无色稍有大蒜味气体.AsH3的沸点高于PH3,其主要原因是
________________________________________________.
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为_____________,与其互为
等电子体的一种分子为______________.
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为__________,As原子采取_______杂化.
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与_______个Ga相连,As与Ga之间存在的化学键有_____________(填字母)。
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
氮化硅是一种重要的结构陶瓷材料,硬度大、耐磨损。利用SiO2和C的混合粉末在N2的气氛中加热至1300℃反应制得。请回答下列问题:
(1)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,则氮化硅的化学式____,晶体类型是;
(2)基态Si原子的电子排布式为_________;Si和C相比,电负性较大的是_________,
(3)在SiO2晶体结构中,O-Si-O的键角是_______,Si原子和周围的四个O原子组成的空间构型为,SiO2中Si的杂化类型_______;
(4)氮化硅抗腐蚀能力强,一般不与其他无机酸反应,但能和氢氟酸反应生成硅酸。试写出该反应的化学方程式。
(5)晶体硅的晶胞如图所示,则每个晶体硅的晶胞中含有个硅原子。
.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应1/3Fe2O3(s)+ CO(g) 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3C. 2α1=α2 D.α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式_______。