25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 |
| D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是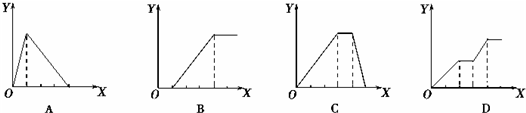
| A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 |
| B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 |
| C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量 |
| D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是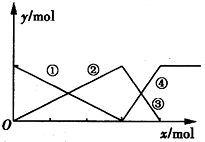
| A.①线表示Al3+的物质的量的变化 |
| B.x表示AlCl3的物质的量 |
| C.③线表示Al(OH)3的物质的量的变化 |
| D.④线表示AlO2-的物质的量的变化 |
下列根据实验操作和现象所得出的结论错误的是
| 选 项 |
实验操作 |
实验现象 |
结论 |
| A |
取久置的Na2O2粉末,向其中滴加过量的硫酸 |
产生无色气体 |
Na2O2没有完全变质 |
| B |
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水至过量 |
实验现象1: 上层溶液不变红,下层溶液呈紫红色 实验现象2: 上层溶液变红 |
氧化性:Br2>Fe3+>I2 |
| C |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al的 |
| D |
取久置的绿矾(FeSO4•7H2O)溶于水,加入KSCN溶液 |
溶液变为红色 |
绿矾部分或全部被氧化 |
下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是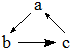
| 选项 |
a |
b |
c |
| A |
Fe |
FeCl2 |
FeCl3 |
| B |
CO2 |
Na2CO3 |
NaHCO3 |
| C |
AlCl3 |
NaAlO2 |
Al(OH)3 |
| D |
Cu |
CuO |
Cu(OH)2 |
下列叙述正确的是
| A.含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 |
| B.Na在空气中长期放置变成Na2CO3粉末 |
| C.过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 |
| D.滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |