下列离子方程式正确的是
| A.钠与水反应2Na+2H+=2Na++H2↑ |
| B.氧化钠与盐酸反应 O2-+2H+=H2O |
| C.碳酸氢钠与稀硫酸反应:CO32-+2H+=CO2↑+H2O |
| D.NaOH溶液与小苏打溶液反应 HCO3-+OH-=CO32-+H2O |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是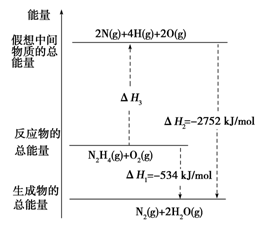
| A.194 | B.391 |
| C.516 | D.658 |
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO32-,则下列推断正确的是
| A.负极反应为H2+2OH--2e-===2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
NH4+、Fe2+、SO42- |
少量Ba(OH)2溶液 |
2NH4++SO42-+Ba2++2OH-===BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO3-、Cl- |
过量NaOH溶液 |
Mg2++2HCO3-+4OH-=== 2H2O+Mg(OH)2↓+2CO32- |
| C |
K+、NH3·H2O、CO32- |
通入少量CO2 |
2OH-+CO2===CO32-+H2O |
| D |
Fe2+、NO3-、SO32- |
NaHSO4溶液 |
SO32-+2H+===SO2↑+H2O |
有a、b、c、d、e五种气体,现进行下列实验:
| (1)a和b混合 |
气体变红棕色 |
| (2)c和d混合 |
产生白烟 |
| (3)c和e分别通入少量溴水中 |
溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 |
都产生淡黄色浑浊 |
则a、b、c、d、e依次可能是
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
下列说法正确的是
| A.原子的最外层电子数等于族序数 |
| B.主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 |
| C.分子结构相似的分子相对分子质量越大熔沸点越高 |
| D.元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |